日志
揭示两种强效抗抑郁疗法背后的共同机制,提出颠覆传统治疗手段 ...
|
Nature 专家点评:
罗敏敏团队首次揭示两种强效抗抑郁疗法背后的共同机制,提出颠覆传统治疗手段
2025-11-06 https://www.biomart.cn/news/15/3249849.htm
导言
近日,我国科研团队在国际顶级学术期刊 自然 上发表研究成果,国际上首次揭示氯胺酮和电休克疗法这两种快速强效抗抑郁疗法背后的共同作用机制 —— 腺苷信号通路。该研究首次证实,「腺苷」这个如同「总开关」般的信号通路,是驱动两种抑郁症治疗方法快速起效的关键所在。基于此,团队提出了一种更安全、更高效的抑郁症非药物治疗方法。
正文
抑郁症是全球主要的精神疾病之一,影响着数亿人的生活。其中,约有三分之一的患者对传统药物反应不佳,医学上称为「难治性抑郁症」。目前,氯胺酮(Ketamine,俗称「K 粉」)和电休克疗法(ECT)是面向这类患者最有效的干预手段,能在数小时内产生强劲疗效。然而,这两种疗法在临床应用上面临着同样的困境:尽管医生们数十年来一直在使用它们挽救生命,但其起效的根本机制始终是个未解的「黑箱」。长期不明的机制,不仅让医生们「知其然而不知其所以然」,更导致这两种疗法伴随的致幻、成瘾、认知损伤等严重副作用难以规避,严重限制了其广泛应用。因此,探索现有抑郁症疗法背后的核心机制,进而开发出更优的治疗策略,是当前抑郁症研究领域的重中之重。
2025 年 11 月 6 日,北京脑科学与类脑研究所罗敏敏实验室在 Nature 期刊发表题为「Adenosine Signalling Drives Antidepressant Actions of Ketamine and ECT」的研究成果。研究发现大脑中一种名为腺苷(Adenosine )的信号分子,是氯胺酮(Ketamine)与电休克疗法(ECT)产生快速抗抑郁作用的核心通路,并基于此提出「间歇性低氧干预方案」(aIH),实现安全、可控地诱发大脑内腺苷释放,从而达到显著抗抑郁效果。
研究者首先利用基因编码的腺苷探针 GRABado,通过光纤光度测量技术,在小鼠体内实现了对特定脑区细胞外腺苷浓度的实时动态监测。研究发现,在给予亚麻醉剂量的氯胺酮后,小鼠内侧前额叶皮层与海马体区域出现了快速且持续的腺苷水平升高,而伏隔核区域则未观察到类似变化。同样,在实施电休克治疗时也观测到了内侧前额叶皮层内类似的腺苷释放。
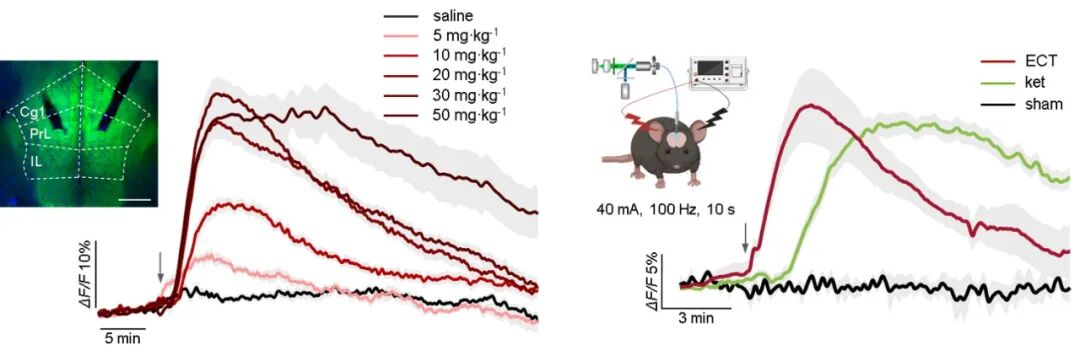
图 1. 氯胺酮(Ketamine)和电休克疗法(ECT)诱导内侧前额叶皮层腺苷激增
接下来,研究者通过遗传学与药理学手段,确证了腺苷信号对于抗抑郁效应的必要性。在腺苷 A1 受体或 A2A 受体基因敲除的小鼠中,氯胺酮与电休克治疗在强迫游泳实验和糖水偏好实验中所表现出的抗抑郁效应完全消失。在野生型小鼠中,系统性给予 A1 或 A2A 受体拮抗剂,同样能够阻断氯胺酮的抗抑郁作用。重要的是,受体敲除并不影响氯胺酮诱导的腺苷释放本身,也不影响其引起的运动亢进效应,表明腺苷信号通路特异性地介导了其治疗作用,而非非特异性的行为效应。
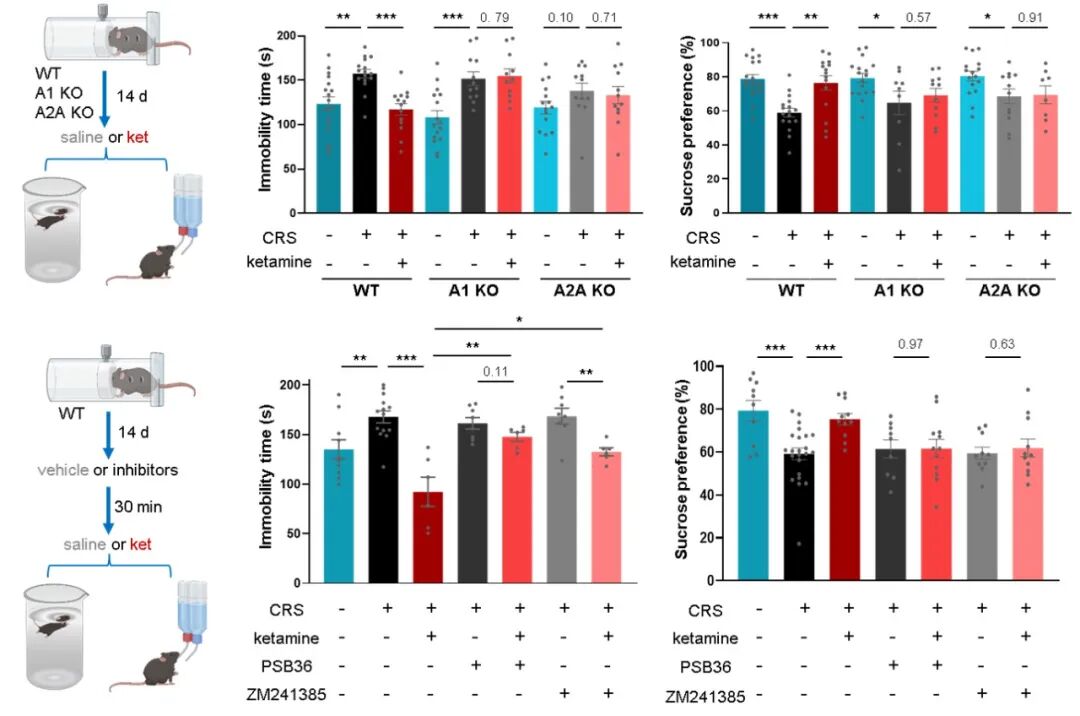
图 2. 遗传学与药理学手段证明腺苷信号介导了氯胺酮的快速抗抑郁表型
为进一步确定腺苷信号的作用脑区,研究者进行了环路层面的功能验证。实验发现,直接向内侧前额叶皮层内注射腺苷,或利用光遗传学技术特异性激活该区域的星形胶质细胞以诱导内源性腺苷释放,均足以在抑郁模型小鼠中产生快速的抗抑郁行为效应。相反,利用 AAV 介导的 CRISPR/Cas9 技术,特异性在内侧前额叶皮层敲低 A1 或 A2A 受体,则阻断了全身给予氯胺酮所产生的治疗效果。这些结果共同表明,内侧前额叶皮层是腺苷信号介导快速抗抑郁作用的关键节点。
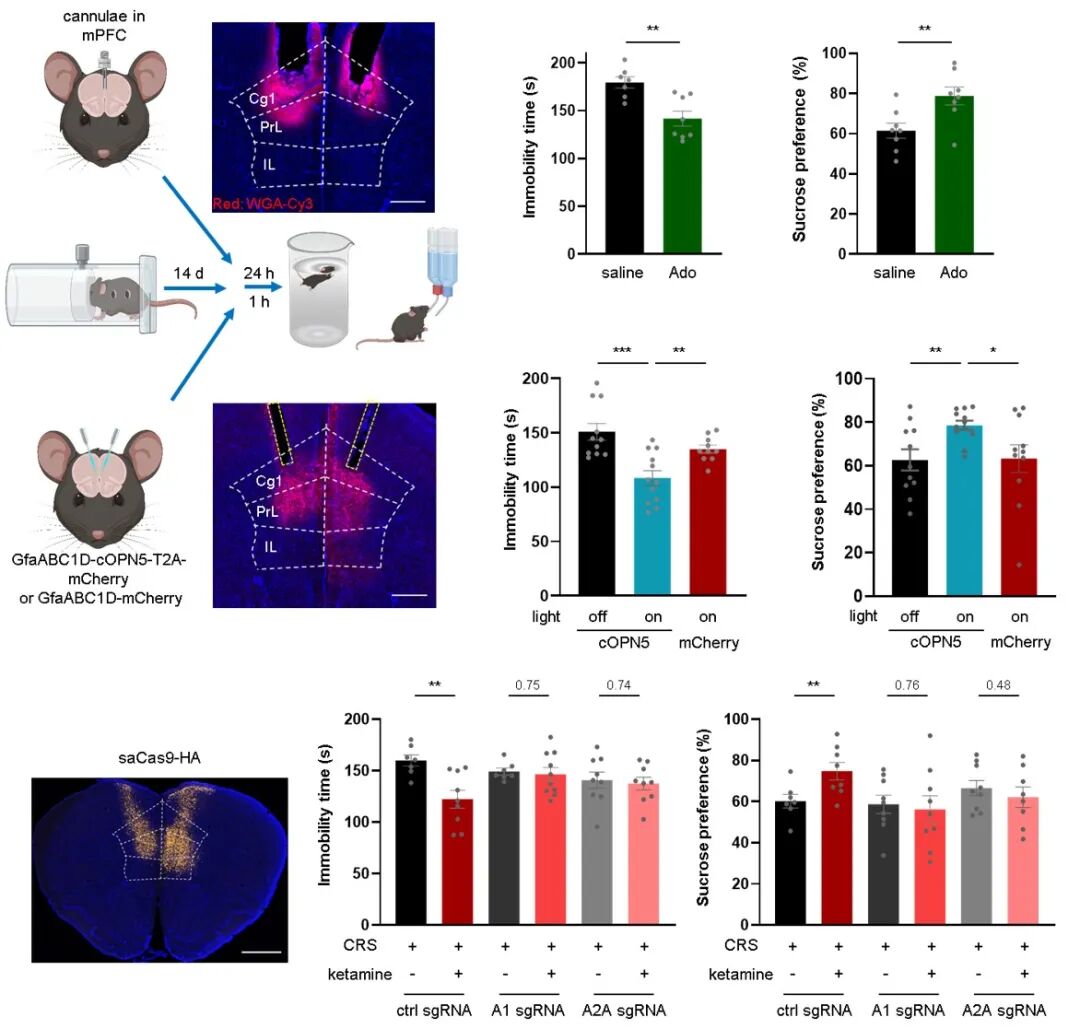
图 3. 内侧前额叶皮层腺苷信号与抗抑郁表型之间的充分必要性
在机制上,研究深入探索了氯胺酮提升细胞外腺苷水平的来源。研究发现,氯胺酮并未引起细胞外 ATP/ADP 水平的升高,且其效应在 CD73 敲除小鼠中依然存在,排除了细胞外核苷酸水解是其主要来源的可能性。进一步实验表明,抑制平衡型核苷转运体 ENT1/2 可显著减弱氯胺酮诱导的腺苷释放,提示其来源为细胞内。利用 ATP/ADP 比率传感器 PercevalHR,研究者观察到氯胺酮能够迅速降低内侧前额叶皮层中兴奋性神经元、抑制性神经元及星形胶质细胞内的 ATP/ADP 比率,且这一代谢变化在时间上早于细胞外腺苷的升高。体外线粒体代谢流分析显示,氯胺酮在治疗相关浓度下可直接抑制线粒体三羧酸循环的代谢通量。这些证据共同勾勒出一条新通路:氯胺酮通过直接调节细胞能量代谢,增加细胞内腺苷,进而通过核苷转运体释放至细胞外。
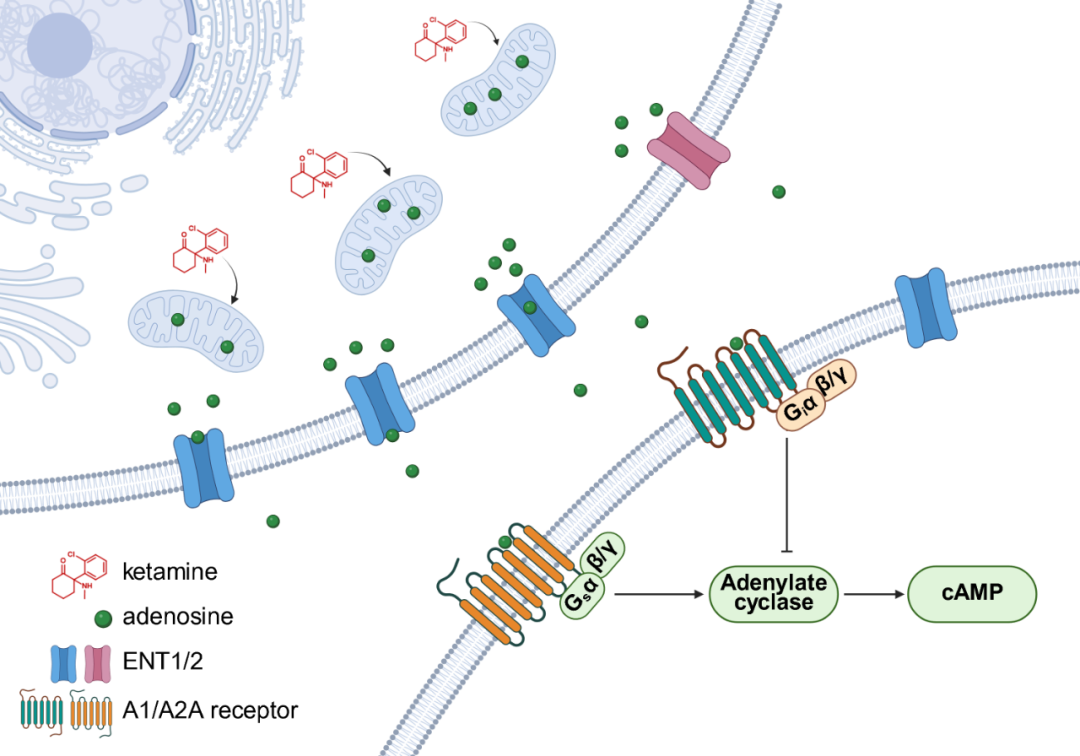
图 4. 氯胺酮诱导大脑腺苷释放机制
基于对上述机制的深入理解,研究者以「增强腺苷释放」为表型指标,设计并筛选了一系列氯胺酮衍生物。其中,去氯氯胺酮在低剂量下即能诱发更强、更持久的腺苷信号,并在行为学测试中表现出优于氯胺酮的抗抑郁功效,同时其引发的运动亢进副作用显著减弱。值得注意的是,化合物的腺苷释放效能与其对 NMDA 受体的抑制强度并无显著相关性,提示其抗抑郁作用存在独立于 NMDAR 抑制的新机制。
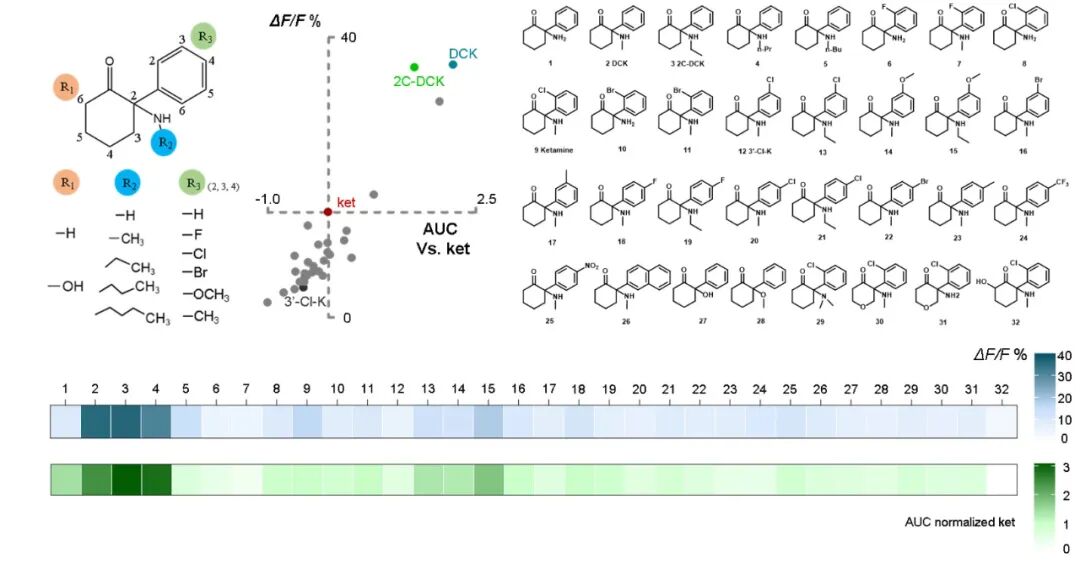
图 5. 基于腺苷表型的药物筛选系统
此外,研究者探索了非药物手段提升脑内腺苷的治疗潜力。研究发现,一种可控的急性间歇性低氧干预方案,能够安全地诱发内侧前额叶皮层内的腺苷释放,并在抑郁模型小鼠中产生依赖于 A1 和 A2A 受体的快速抗抑郁效应。
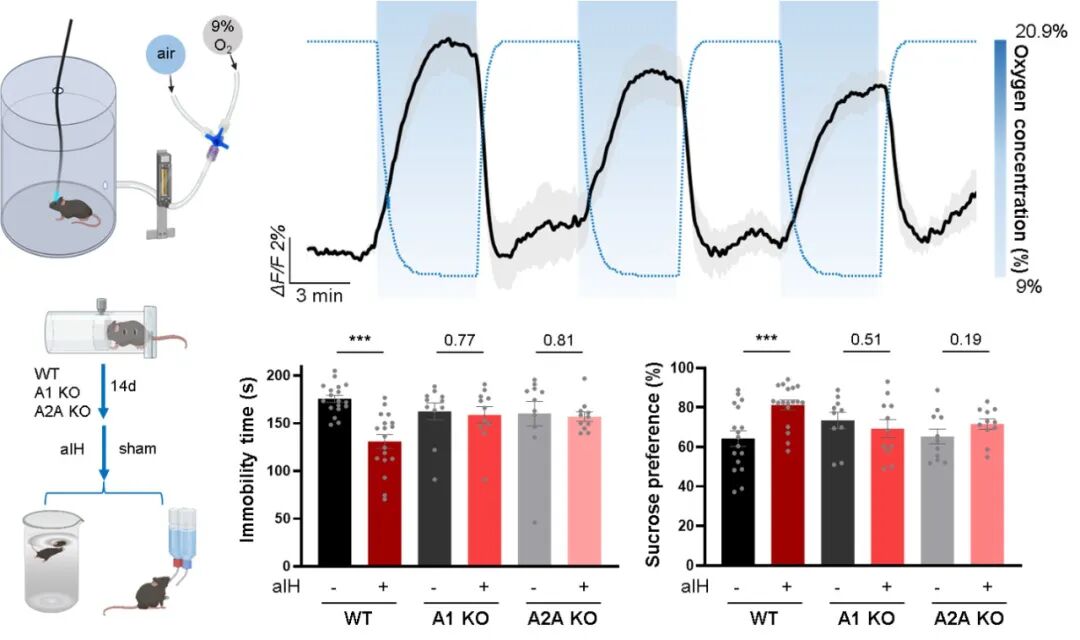
图 6. 急性间歇性缺氧诱导腺苷释放并减轻抑郁样表型
综上所述,本研究发现并证实了腺苷信号通路是氯胺酮与电休克治疗产生快速抗抑郁作用的共同关键机制。这一发现不仅深化了我们对快速抗抑郁机制的理解,也为开发新一代基于腺苷信号调控的、副作用更小的抗抑郁策略(包括小分子药物与非药物干预)提供了坚实的理论依据和明确的靶点。
面对这一长期困扰医学界的难题,北京脑科学与类脑研究所罗敏敏团队在近期发表的研究中取得了关键突破。利用前沿的基因编码荧光探针技术,团队首次在活体大脑中「看见」了氯胺酮和电休克治疗都会在情绪调控关键脑区引起腺苷水平的急剧、持续飙升,揭示了这两种看似迥异的疗法背后共同的启动信号。
为了充分证明腺苷与治疗方法间的因果关系,团队进一步设计遗传学与药物试验:当「关闭」大脑感知腺苷信号的接收器时,两种疗法的抗抑郁效果便完全消失;而直接激活该通路则能产生明确抗抑郁效果。这些决定性证据证明了腺苷信号通路不仅具有相关性,更是起效的必要条件。
这一发现的核心价值在于,它将疗效与副作用成功「解绑」。研究表明,氯胺酮激活腺苷通路,主要通过调节细胞的能量代谢,而非传统认为的 NMDAR 受体通路,而后者恰恰与致幻等副作用密切相关。这一「解绑」为开发「取其精华,去其糟粕」的新一代药物提供了清晰的路线图。基于此原理,团队成功设计并合成出新型氯胺酮衍生物。在动物实验中,该药物在更低的剂量下就能达到甚至超越氯胺酮的抗抑郁效果,且其引起的副作用显著降低,展示了巨大的临床转化潜力。
不仅如此,该研究还为非药物治疗带来了新思路。团队发现,一种名为「急性间歇性低氧」(aIH)的安全物理干预手段(即让动物短暂、可控地呼吸低氧空气),同样能有效激活大脑腺苷信号,产生强大的抗抑郁效果。这为后续开发完全非侵入、无药物依赖的生理疗法奠定了坚实基础。
总而言之,这项研究将快速抗抑郁疗法从「经验性使用」推向了机制明确的精准医学时代,统一了药理、电击和生理干预手段背后的核心生物学原理。这不仅解决了困扰该领域数十年的科学谜题,更为开发下一代安全、高效的抗抑郁疗法提供了清晰靶点和可行的技术路径,为全球数亿深陷痛苦的难治性抑郁症患者带来了新曙光。
研究信息
该研究由北京脑科学与类脑研究所的罗敏敏实验室牵头,实验室博士后乐晨雨、博士生王娜、博士后袁正巍等共同完成,并联合了长春应化所王晓辉团队(负责新药合成,共同通讯)、北京大学李毓龙团队(负责探针工具开发) 等多个实验室协同完成。研究得到了中国医学科学院创新工程及医学创新基金、中国脑计划、国家自然科学基金、以及新基石研究员项目等的大力支持。
专家点评
1. 冯国平,博士(神经科学波伊特拉斯讲席教授、Hock E. Tan 与 K. Lisa Yang 自闭症研究中心主任、麦戈文脑研究所副所长 脑与认知科学系 麻省理工学院)
原文:Ketamine and ECT can rapidly pull people from the brink of severe depression, but their use has been limited by significant side effects, largely because their mechanisms were a mystery. This study provides a major breakthrough by identifying a single signaling molecule, adenosine, as the master switch for both. This represents a true paradigm shift because the answer wasn't where most were looking—it's tied to the cell's energy machinery. This insight is more than a discovery; it's a blueprint that shows us how to decouple the therapeutic benefit from side effects. Impressively, the study validates this blueprint by identifying more potent drug candidates and a promising non-invasive therapy based on the same mechanism. This type of mechanism-based precision medicine is the key to developing a new generation of safer, more targeted therapies.
译文:氯胺酮与电休克疗法能够快速挽救深陷重度抑郁的患者,但其显著副作用始终限制着临床应用 —— 这主要源于其作用机制长期成谜。本研究取得的重大突破在于,它发现单一信号分子腺苷正是这两种疗法共同作用的主控开关。
这代表着一次真正的范式转变,因为答案并未出现在多数人寻找的方向上 —— 而是与细胞的能量代谢机制紧密相连。这一洞见不仅是一项科学发现,更是一张蓝图,向我们揭示了如何将治疗效果与副作用分离开来。
令人赞叹的是,研究通过基于同一机制,筛选出更强效的候选药物及开发前景广阔的无创疗法,成功验证了这张蓝图的可行性。这种基于机制的精准医学策略,正是开发新一代更安全、靶向性更强疗法的关键所在。
2. Christian Lüscher(来自日内瓦大学,是瑞士日内瓦大学神经科学教授及脑研究中心(CIBM 与基础神经科学系)主任。他是突触可塑性、成瘾机制及神经精神疾病神经环路研究领域的权威专家。曾荣获多项重要奖项,包括瑞士神经科学学会奖、欧洲神经精神药理学学会奖以及 Wilhelm Schulthess 基金会奖。同时,他也是欧洲分子生物学组织(EMBO)和德国国家科学院利奥波第那的成员。)
原文:A new study by Yue and colleagues brings adenosine, a purine nucleoside, into sharp focus. Adenosine has been implicated in orchestrating neuronal inhibition and synaptic plasticity, but its effects on behavior or disease involvement however has long been puzzling. The researchers now show that adenosine may be the missing link between two very different but fast-acting depression treatments: ketamine and electroconvulsive therapy. Using advanced imaging tools, they found brief bursts of adenosine in a key mood region of the brain that are both required and sufficient for these therapies to work. This discovery unites decades of fragmented findings in a fierce scientific debate. The study opens the door for further mechanistic studies examining how adenosine affects brain circuits dysfunctional in depression. Most importantly, it provides a roadmap for the discovery of safer, more accessible antidepressants built on the brain’s own chemistry.
译文:乐及其同事的一项新研究使嘌呤核苷 —— 腺苷 —— 成为了焦点。腺苷一直被认为参与调控神经元抑制和突触可塑性,但其对行为的影响或与疾病的关联长期以来令人困惑。研究人员现在揭示,腺苷可能是连接两种截然不同但起效迅速的抑郁症疗法 —— 氯胺酮与电休克疗法 —— 之间所缺失的关键环节。通过先进成像技术,他们发现大脑关键情绪区内腺苷的瞬时释放,既是这些疗法起效的必要条件,也足以促成其疗效。这一发现统一了数十年来在这场激烈的科学争论中零散的研究结果。该研究为进一步探索腺苷如何影响抑郁症中功能异常的神经环路机制打开了大门。最重要的是,它为我们提供了一张路线图,指引我们基于大脑自身化学机制,去发现更安全、更易获得的抗抑郁疗法。
原文链接:




